TINCIÓN DE ZIEHL – NEELSEN
Objetivo:
Diferenciar tipos bacterianos capaces de resistir la decoloración
ácida, hecho que es debido a la gran cantidad de componentes micólicos que
forman parte de la pared bacteriana de este tipo de bacterias.
Fundamento:
Existen determinados grupos bacterianos que contienen en su pared
una gran cantidad de componentes lipoideos y cereos, de tal forma que este tipo
de bacterias presentarán grandes dificultades a la hora de teñirse con los
colorantes convencionales que no pueden penetrar en el interior de estas
bacterias. Por eso se necesitan colorantes altamente concentrados y la
presencia de calor que facilite su penetración al interior de dichas bacterias.
Una vez que estas bacterias han quedado teñidas no se pueden decolorar,
resisten incluso a decoloraciones ácidas. Aprovechando esto, podemos
diferenciar este tipo de bacterias, como es el caso del género Mycobacterium,
del resto que no presenta esta propiedad. Las que sean resistentes quedarán de
color rosa, pues resisten la decoloración con alcohol ácido, las no resistentes
quedarán de color azul.
Lo haremos mediante la tinción de Ziehl – Neelsen, una tinción
diferencial, en la que se utiliza la fucsina fenicada en caliente para que
pueda penetrar en la pared de las bacterias BAAR (ácido resistentes) pues dicha
pared es fluidificada debido al calor A continuación, aplicamos alcohol ácido
sobre la extensión, los ácidos micólicos y las ceras de la pared de las
bacterias ácido resistentes, se vuelven a solidificar, atrapando el colorante e
impidiendo que la mezcla de alcohol ácido decolore la bacteria. Al final de
esta fase, las bacterias ácido resistentes quedarán coloreadas de rosa debido a
la fucsina fenicada, y las que se han decolorado estarán incoloras. Finalmente,
echamos el colorante de contraste, azul de metileno, el cual no podrá penetrar
la pared de las bacterias ácido resistentes, pero si a las demás bacterias.
Quedando de esta manera las bacterias que no son resistentes al ácido de color
azul, y las que sí lo son, de color rosa.
Este tipo de tinción se suele utilizar para diagnosticar y
estudiar las enfermedades producidas por bacterias ácido-resistentes, como la
tuberculosis y la lepra.
Material:
- Portaobjetos
- Pinzas de madera
- Asa de siembra
- Mechero Bunsen
- Pipeta Pasteur
- Cristalizador
- Asa de tinciones
- Frasco lavador
- Muestra problema
- Aceite de inmersión
- Solución fenicada de fucsina básica
- Solución hidroalcohólica de azul de metileno
- Alcohol ácido al 3%.
Procedimiento:
1. Realizar preparación con su correspondiente fijación.
2. Cubrir la preparación con fucsina fenicada básica durante 5
minutos aplicando calor en este tiempo con una torunda hasta la emisión de
vapores, evitando que se caliente demasiado o que se seque el colorante.
3. Lavar abundantemente con agua destilada hasta arrastrar el
colorante, con cuidado de no llevarnos la muestra de por medio.
4. Decolorar en frío con alcohol ácido hasta arrastrar los restos
de colorante (2 minutos).
5. Lavar abundantemente con agua destilada.
6. Cubrir la preparación con colorante de contraste, nosotros
hemos utilizado azul de metileno, dejar 2 minutos sin necesidad de calentar.
7. Lavar, secar y observar con objetivo de inmersión.
Resultados e interpretación
Hemos realizado esta tinción en 4 muestras. Nuestras 2 muestras de
estudio: 5 y 8. Y en dos muestras proporcionadas por el profesor, rotuladas con
AAR 1 y AAR 2.
Los resultados son los siguientes:
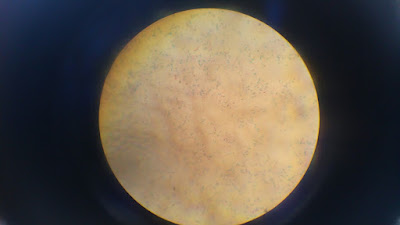
- AAR 1: Podemos observar bacilos y entre ellos se han situado
esporas. Se quedan de color azul, esto quiere decir que no son ácido
resistentes, ya que conservan el colorante de contraste.
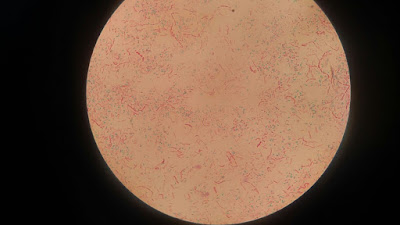
- AAR 2: Hay bacilos ácido resistentes, pues aparecen de color
rosa.
- Muestra 5: No hay bacilos ácido resistentes, ya que han sido decolorados
y coloreados con el colorante de contrastes, azul de metileno.
- Muestra 8: Mayoritariamente encontramos bacilos sin ácido
resistencia, pero hemos encontrado algunos de color rosa, lo que indica que su
pared es ácido resistente pues no ha sido decolorada con el alcohol ácido.
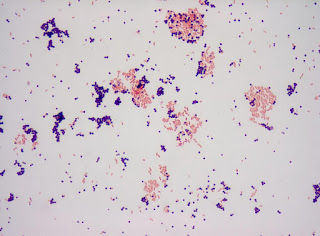
En esta tinción hemos observado bacilos de color rosa que indican
ácido alcohol resistencia positiva, es decir, son resistentes a la decoloración
ácida (característica del género de Mycobacterium y algunas especies de
Nocardia). Así, los bacilos se diferencian del resto de bacterias que no
presentan esta propiedad y que se tiñen entonces con azul de metileno
presentando color azul.